고정화 CALB
CALB는 거대 다공성의 스티렌/메타크릴레이트 중합체인 고 소수성 수지에 물리적 흡착에 의해 고정됩니다.고정화 CALB는 유기 용제 및 무용제 시스템의 응용 분야에 적합하며 적절한 조건에서 여러 번 재활용 및 재사용할 수 있습니다.
제품 코드: SZ-CALB- IMMO100A, SZ-CALB- IMMO100B.
★높은 활성, 높은 키랄 선택성 및 높은 안정성.
★비수성 단계에서 더 나은 성능.
★반응 시스템에서 쉽게 제거하고 반응을 신속하게 종료하며 제품의 단백질 잔류물을 방지합니다.
★재활용 및 재사용이 가능하여 비용을 절감할 수 있습니다.
| 활동 | ≥10000PLU/g |
| 반응을 위한 pH 범위 | 5-9 |
| 반응 온도 범위 | 10-60℃ |
| 모습 | CALB-IMMO100-A: 밝은 노란색에서 갈색 고체 CALB-IMMO100-B: 흰색에서 밝은 갈색 고체 |
| 입자 크기 | 300-500μm |
| 105℃ 건조감량 | 0.5%-3.0% |
| 고정용 수지 | 거대 다공성, 스티렌/메타크릴레이트 폴리머 |
| 반응 용매 | 물, 유기 용제 등 또는 용제 없이.일부 유기 용매에서의 반응의 경우 반응 효과를 향상시키기 위해 3% 물을 첨가할 수 있습니다. |
| 입자 크기 | CALB-IMMO100-A: 200-800μm CALB-IMMO100-B: 400-1200μm |
단위 정의: 1단위는 60℃에서 라우르산과 1-프로판올로부터 분당 프로필 라우레이트 1μmol의 합성에 해당합니다.상기 CALB-IMMP100-A 및 CALB-IMMO100-B는 입자 크기가 다른 고정화 담체에 해당합니다.
1. 반응기 유형
고정화 효소는 케틀 배치 반응기와 고정층 연속 유동 반응기 모두에 적용할 수 있습니다.먹이거나 채우는 동안 외력에 의해 찌그러지지 않도록 주의해야 합니다.
2. 반응 pH, 온도 및 용매
고정화 효소는 다른 물질을 첨가하여 용해시킨 후 pH를 조정한 후 마지막에 첨가해야 합니다.
기질의 소모 또는 생성물의 형성으로 인해 반응 중 pH가 변할 경우 반응 시스템에 충분한 완충액을 추가하거나 반응 중에 pH를 모니터링하고 조정해야 합니다.
CALB의 온도 허용 범위(60℃ 이하) 내에서 온도가 증가함에 따라 전환율이 증가하였다.실제 사용시 반응 온도는 기질 또는 생성물의 안정성에 따라 선택해야 합니다.
일반적으로, 에스테르 가수분해 반응은 수상계에서 적합하고, 에스테르 합성 반응은 유기상계에서 적합하다.유기 용매는 에탄올, 테트라히드로푸란, n-헥산, n-헵탄 및 톨루엔, 또는 적합한 혼합 용매일 수 있다.일부 유기 용매에서의 반응의 경우 반응 효과를 향상시키기 위해 3% 물을 첨가할 수 있습니다.
3. CALB의 재사용 및 수명
적절한 반응 조건에서 CALB를 회수하여 재사용할 수 있으며 특정 적용 시간은 프로젝트마다 다릅니다.
회수된 CALB를 연속적으로 재사용하지 않고 회수 후 보관해야 하는 경우에는 세척 및 건조 후 2~8℃에서 밀봉해야 합니다.
몇 차례 재사용한 후 반응 효율이 약간 감소하면 CALB를 적절히 첨가하여 계속 사용할 수 있습니다.반응 효율이 심각하게 저하되면 교체해야 합니다.
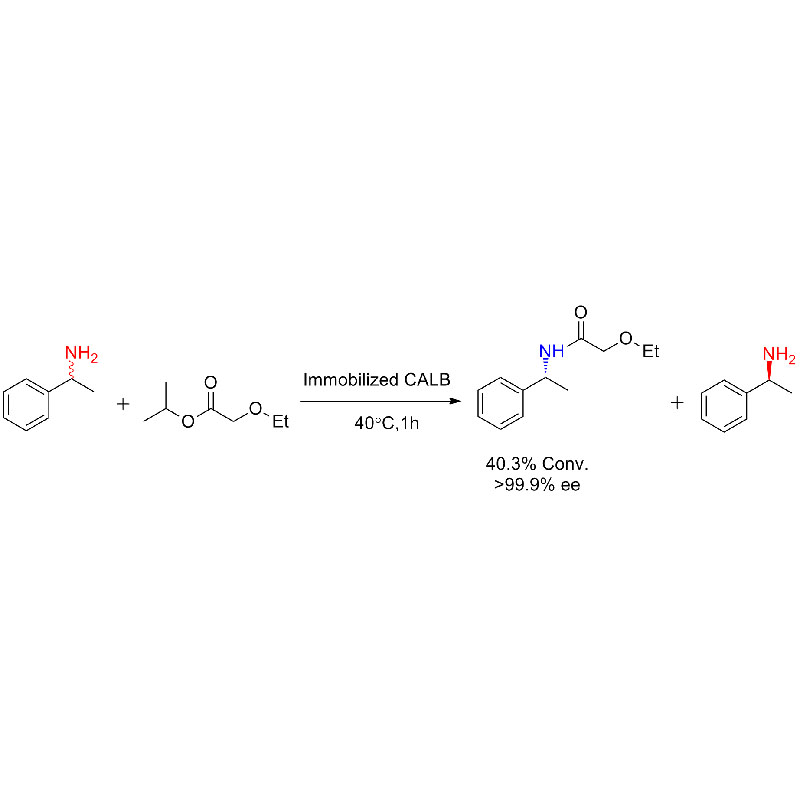
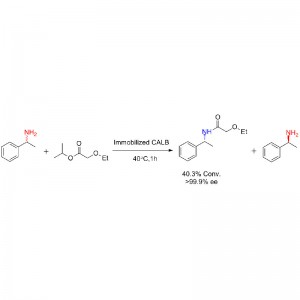
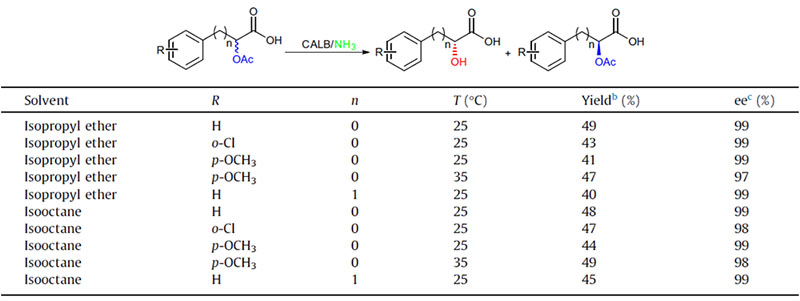
실시예 1(아미노분해)(1):
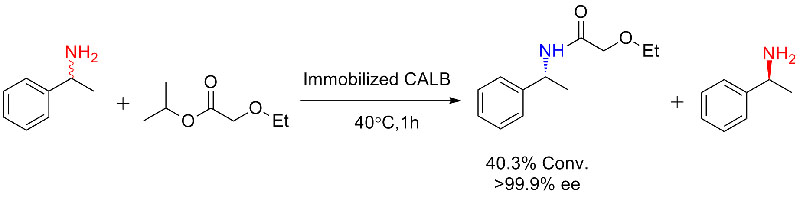
실시예 2(아미노분해)(2):
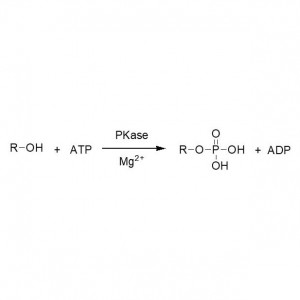
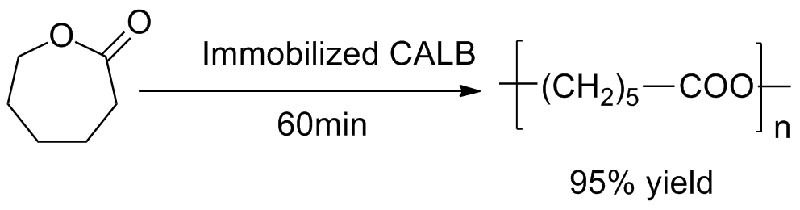
실시예 3(개환 폴리에스테르 합성)(삼):
실시예 4(에스테르 교환 반응, 수산기의 위치선택적)(4):
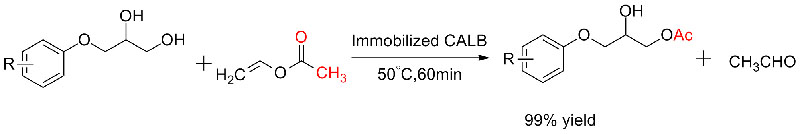
실시예 5(에스테르 교환, 라세미 알코올의 동역학적 분해능)(5):
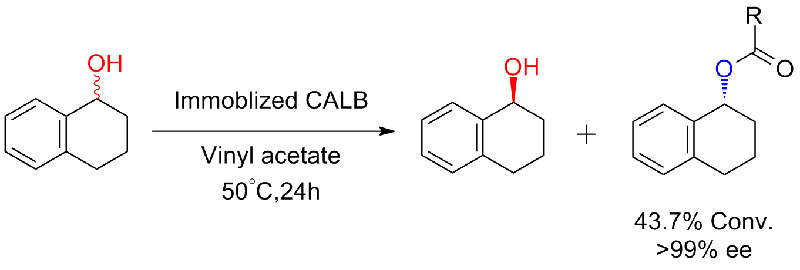
실시예 6(에스테르화, 카르복실산의 동역학적 분해능)(6):
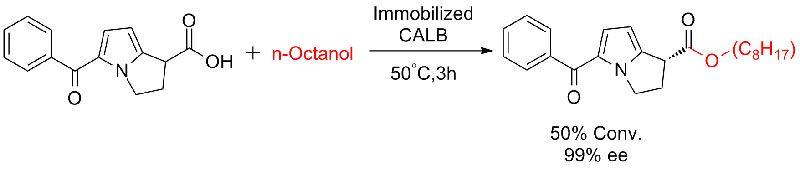
실시예 7(에스테르화 분해, 동역학적 분해능)(7):
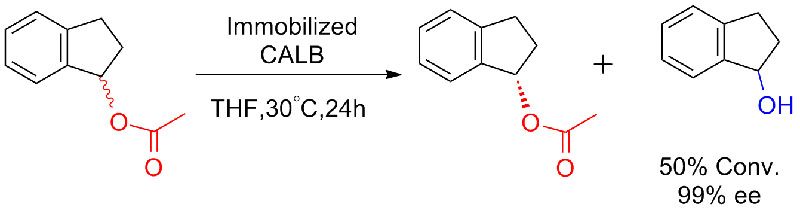
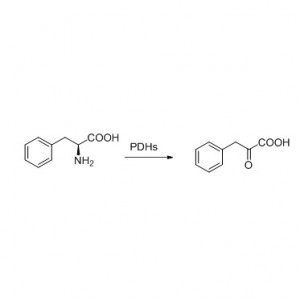
실시예 8(아미드의 가수분해)(8):
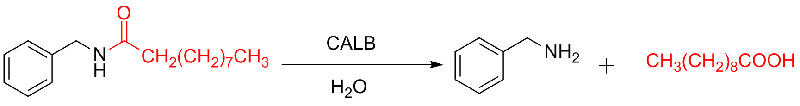
실시예 9(아민의 아실화)(9):
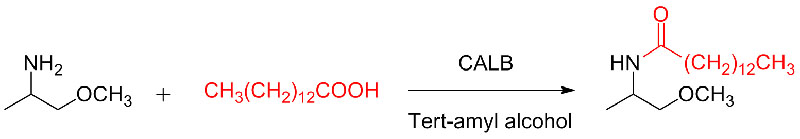

실시예 10(Aza-Michael 부가 반응)(10):
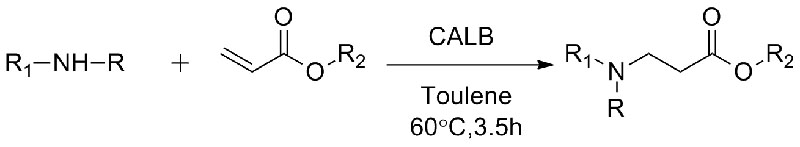
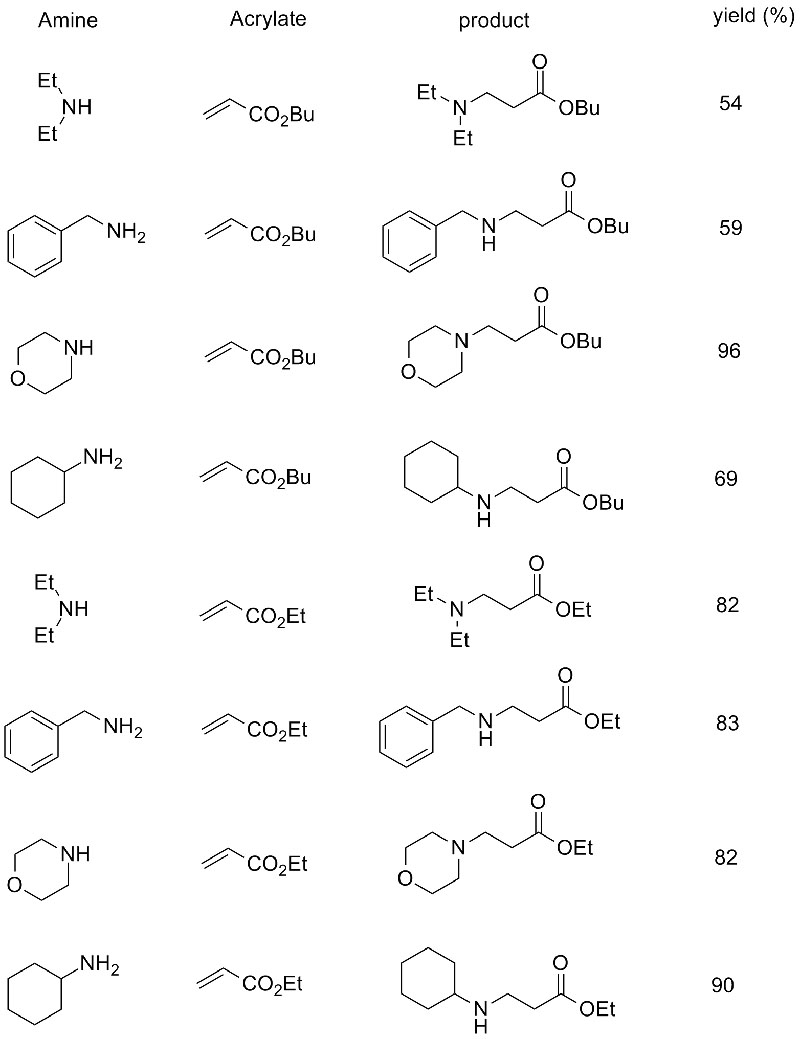
1. Chen S, Liu F, Zhang K, et al.Tetrahedron Lett, 2016, 57: 5312-5314.
2. Olah M, Boros Z, anszky GH, et al.사면체, 2016, 72: 7249-7255.
3. Nakaoki1 T, Mei Y, Miller LM, et al.Ind. Biotechnol, 2005, 1(2):126-134.
4. Pawar SV, Yadav G DJ Ind. Eng.Chem, 2015, 31: 335-342.
5. Kamble MP, Shinde SD, Yadav G DJ Mol.카탈.B: Enzym, 2016, 132: 61-66.
6. Shinde SD, Yadav G D. Process Biochem, 2015, 50: 230-236.
7. Souza TC, Fonseca TS, Costa JA 등J. 몰.카탈.B: Enzym, 2016, 130: 58-69.
8. Gavil'an AT, Castillo E, L'opez-Mungu'AJ Mol.카탈.B: Enzym, 2006, 41: 136-140.
9. Joubioux FL, Henda YB, Bridiau N, et al.J. 몰.카탈.B: Enzym, 2013, 85-86: 193-199.
10. Dhake KP, Tambade PJ, Singhal RS, et al.Tetrahedron Lett, 2010, 51: 4455-4458.